Siembra de hongos anaerobios

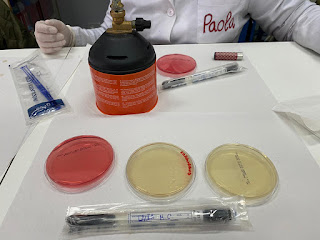
Siembra de hongos Parte 2 Material Mechero Bunsen Hisopos estériles Bote de orina como cementerio Placas de Petri con medio de cultivo: Agar Sangre y Agar Chocolate Procedimiento 1.Con un hisopo estéril tomamos una muestra de la boca. 2. Sembramos con la técnica por agotamiento de estrías en Agar Chocolate. 3.Metemos nuestros cultivos en una cámara para anaerobios. 4. Colocamos un sobre que hará que la atmósfera de la cámara adquiera condiciones anaerobias. 5.Metemos nuestra cámara a la incubadora a 37oC durante 24 horas. Lectura de los resultados: